09 Jun AGPU Omega 3 – Diferencias entre etil-esteres, trigliceridos y fosfolípidos
Fosfolípidos de origen marino: una nueva alternativa para la suplementación con ácidos grasos omega-3
Autores:
Alfonso Valenzuela B. (1,2) , Rodrigo Valenzuela B. (3), Julio Sanhueza C. (1), Fernando de la Barra D. (4), Gladys Morales I. (5).
(1) Centro de Lípidos, Instituto de Nutrición y Tecnología de los Alimentos (INTA), Universidad de Chile. Santiago, Chile.
(2) Facultad de Medicina, Universidad de los Andes, Santiago, Chile.
(3) Departamento de Nutrición, Facultad de Medicina, Universidad de Chile. Santiago, Chile. (4) Departamento de Ingeniería Química y Bioprocesos, Facultad de Ingeniería, Pontificia Universidad Católica de Chile. Santiago, Chile.
(5) Departamento de Salud Pública. Facultad de Medicina.
Universidad de La Frontera, Temuco- Chile.
Este trabajo fue recibido el 4 de Julio de 2014 y aceptado para ser publicado el 21 de Septiembre de 2014.
INTRODUCCIÓN
Los beneficios para la salud derivados del consumo y/o suplementación con ácidos grasos poliinsaturados omega-3 de cadena larga (AGPICL omega-3), eicosapentaenoico (C20:5, EPA) y docosahexaenoico (C22:6, DHA), están suficientemente documentados en la literatura médica y nutricional (1-3). Se les atribuye efectos hipotrigliceridémicos, hipocolesterolémicos, antitrombóticos, antinflamatorios (4, 5), reguladores y protectores de la función del sistema nervioso (6), efecto protector del desarrollo de enfermedades neurodegenerativas, entre otros (7, 8), lo cual ha derivado en numerosas recomendaciones médicas y nutricionales que propician su consumo habitual (9), incluidos la Organización para la Alimentación y Agricultura (10) y la Organización Mundial de la Salud (OMS), (11). La recomendación es aumentar el consumo de productos del mar, especialmente de pescados grasos (o azules) los que constituyen un buen aporte de AGPICL omega-3, especialmente de EPA y DHA (12). Sin embargo, es conocido el bajo consumo de pescado en numerosos países y la creciente escases de este recurso derivada principalmente de la sobrecaptura, la que en un importante volumen deriva hacia la fabricación de harina y aceite para uso en nutrición animal, incluida la acuicultura (13). La suplementación con aceite de pescado, el que puede contener hasta un 30% de EPA + DHA, no siempre resulta adecuada y aceptable. Si bien el aceite de pescado se puede desodorizar y también reducir su oxidación mediante el uso de antioxidantes, en poco tiempo revierte su olor típico e inicia procesos de oxidación que lo hacen indeseable e incluso su consumo en estado oxidado puede constituir eventualmente un peligro para la salud (14). Además, como su composición está integrada casi exclusivamente por triglicéridos apolares, lo cual lo transforma en un producto que no se puede incorporar directamente a matrices mayoritariamente acuosas, su aplicación como vehículo de suplementación de AGPICL omega-3 es muy limitada.
La industria farmacéutica y nutracéutica ha desarrollado alternativas para mejorar el consumo de aceites marinos (15). Estos aceites se pueden encapsular (cápsulas blandas, muy comunes) (15), microencapsular (16) e incluso nanoencapsular (17). La encapsulación es la forma más habitual y organolépticamente menos compleja para aportar EPA + DHA, pero no es fácilmente aceptada por todos por el tamaño de las cápsulas (contienen hasta 3 gr de aceite), sobre todo por los más pequeños y los más ancianos. La microencapsulación es de relativamente de alto costo, comparada con la encapsulación que es de bajo costo, y no siempre se consigue el desarrollo de un producto adecuado como suplemento (que aporte suficiente cantidad de AGPICL omega-3) y además, bajo ciertas circunstancias, los productos adicionados de microcápsulas terminan presentando el indeseable “olor o sabor a pescado” (18).
La nanoencapsulación es un proceso más reciente aunque de alto costo y sólo permite aportes muy pequeños de EPA + DHA. Se ha optado por concentrar estos ácidos grasos en forma conjunta o individual, mediante procedimientos de destilación molecular, con lo cual están disponibles preparaciones de EPA + DHA con 60-70% de ácidos grasos o preparaciones individuales (EPA o DHA) en forma libre o como etil-ésteres que pueden alcanzar hasta un 90% de cualquiera de estos ácidos grasos. Estas preparaciones están orientadas principalmente a la industria farmacéutica, requeridos para uso médico con alto grado de pureza (libres de contaminantes como metales pesados, dioxinas, policíclicos aromáticos y eventualmente de colesterol) y altos niveles de concentración de AGPICL omega-3 (19). Los concentrados de AGPICL omega-3 pueden reconvertirse nuevamente a triglicéridos mediante procedimientos enzimáticos (20).
En resumen, no es fácil lograr una adecuada ingesta de AGPICL omega-3, ya sea debido al bajo consumo de pescado de algunas poblaciones, incluida la chilena , o debido a los problemas tecnológicos y organolépticos que ocasiona el uso de aceites marinos como vía de inclusión de estos ácidos grasos para desarrollar productos destinados a la suplementación. Una alternativa más reciente y muy interesante, la constituyen los fosfolípidos de origen marino (FM), cuyas características estructurales y funcionales los hacen muy diferentes de los triglicéridos. Este trabajo revisa las principales características y posibilidades de utilización de este tipo de lípidos obtenidos de fuentes no convencionales, como lo son los fosfolípidos obtenidos de aceites extraídos de crustáceos, de la harina de pescado, huevas de pescado inmaduro o de los sub-productos de la industria acuicultora.
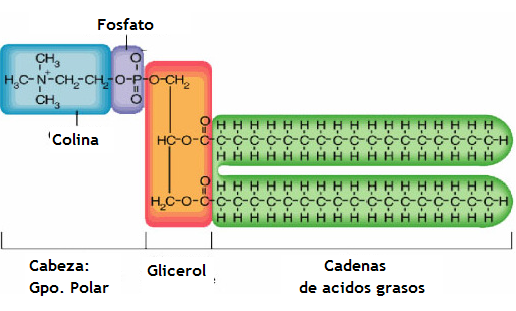
Los fosfolípidos son un tipo de lípidos considerados como polares, ya que a diferencia de los triglicéridos que son totalmente apolares, los fosfolípidos presentan cierta densidad de carga eléctrica que les permite asociarse con solventes polares, como el agua. Están integrados por una molécula de glicerol (un trialcohol) al que se unen dos ácidos grasos y una molécula de ácido ortofosfórico. A esta estructura se le conoce como ácido fosfatídico y normalmente se encuentra como tal en muy bajas concentraciones en los tejidos debido a que generalmente el grupo ortofosfato está unido a una base orgánica como la etanolamina o la colina, a algún aminoácido como la serina o a un alcohol cíclico como el inositol, los que respectivamente dan origen a los fosfolípidos fosfatidiletanolamina, fosfatidilcolina (más conocida como lecitina), fosfatidilserina y fosfatidilinositol. De esta forma, los fosfolípidos presentan una parte polar (el fosfato sustituido con las moléculas ya mencionadas) y una parte apolar, formada por los ácidos grasos que sustituyen al glicerol.
Se les define como moléculas anfipáticas (anfi= ambos, pathos= sensación) (21). Los ácidos grasos que se unen al glicerol generalmente son poliinsaturados. Por ejemplo, en los fosfolípidos de origen vegetal terrestre, es común encontrar ácido linoleico (C18:2, omega-6) y ácido alfa linolénico (C18:3, omega-3). En los fosfolípidos obtenidos de animales terrestres es frecuente encontrar ácido alfa linolénico y ácido araquidónico (C20:4, omega-6, AA) y solo en algunos tejidos, DHA (cerebro, retina, gónadas). No es frecuente encontrar EPA, salvo que los fosfolípidos provengan de un individuo (humano o animal) que consuma directamente este ácido graso, ya que el destino normal del EPA es transformarse en DHA y depositarse como tal en los tejidos ya mencionados (22).
En los FM la situación es diferente, por ejemplo, es habitual encontrar EPA y DHA como sustituyentes en los fosfolípidos obtenidos de animales marinos y en forma menos frecuente, AA (21, 23). En los fosfolípidos obtenidos de vegetales marinos (principalmente microalgas) se encuentra altas concentraciones de DHA y de AA y concentraciones muy pequeñas de EPA (23, 24).
Funciones y propiedades de los fosfolípidos.
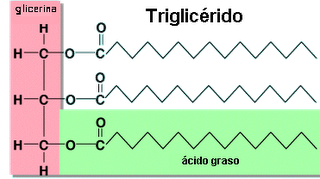
Los fosfolípidos tienen funciones y propiedades muy diferentes a los triglicéridos. Su carácter anfipático les permite formar estructuras micelares mono-capa o doble capa, siendo esta última estructuración la base para la formación de las membranas biológicas (24), estructuras que probablemente permitieron el origen de la vida al facilitar el desarrollo de un sistema aislado del ambiente y que pudo compartimentarse formando las primeras células. Los triglicéridos, por su carácter apolar se depositan en el interior de las células formando grandes gotas de grasa y que constituye la reserva energética de los tejidos tanto animales como vegetales (25). La composición de ácidos grasos de los triglicéridos es muy dependiente, en el caso de los animales, del aporte dietario. En cambio, la composición de ácidos grasos de los fosfolípidos es muy estable, favoreciéndose la incorporación de ácidos grasos insaturados, particularmente AGPICL omega-3 y omega-6, con la finalidad de mantener una fluidez en las membranas adecuada a su función biológica (21).
La biodisponibilidad a nivel intestinal de los ácidos grasos, cuando son aportados en la forma de fosfolípidos, es sustancialmente mayor que cuando son aportados como triglicéridos (21), aspecto que es muy importante cuando se trata de suplementación con un tipo específico de ácidos grasos, por ejemplo EPA y/o DHA (26). Además, la estabilidad a la oxidación de los AGPICL, a la cual son muy susceptibles, es mayor cuando estos ácidos grasos se encuentran en la estructura de los fosfolípidos (27), aspecto que es de importancia desde el punto de vista de la estabilidad de las estructuras celulares y también de aquellos productos que sean adicionados de este tipo de fosfolípidos.
Tecnológicamente los fosfolípidos son muy útiles ya que son emulsionantes y emulsionables, esto es, permiten estabilizar matrices acuosas que contienen otros componentes (proteínas, carbohidratos, vitaminas, entre otros), lo cual es muy utilizado en la formulación de cremas, productos cosméticos, medicamentos, entre otros. Si lo que se quiere agregar son fosfolípidos, estos de incorporan muy bien a matrices acuosas (leche, yogur, bebidas, entre otros) emulsionándose o disolviéndose en matrices oleosas (aceites comestibles,cremas,mantecas, etc.,) (23). Estas propiedades, que no las tienen los triglicéridos, hacen de los fosfolípidos productos de uso industrial de gran versatilidad.
Fosfolípidos de origen marino.
Actualmente se visualiza a los FM como una fuente muy interesante para aportar AGPICL omega-3 (16), siendo varios los motivos que avalan esta afimación; concentran principalmente DHA (cuando provienen de huevas, peces o mamíferos marinos) y DHA y AA cuando provienen de vegetales marinos (mayoritariamente microalgas). Son más estables al desarrollo de procesos oxidativos que los triglicéridos con composición equivalente de AGPICL (27). A nivel digestivo, los ácidos grasos tienen mayor biodisponibilidad cuando provienen de fosfolípidos que los aportados por la hidrólisis de los triglicéridos (28, 29). Son de más fácil manejo tecnológico por su carácter anfipático, lo que los hace emulsionantes y emulsionables. Además, tienen una propiedad que les es única; las moléculas sustituyentes al grupo ortofosfato. La etanolamina que se obtiene de la fosfatidiletanolamina y la colina que aporta la fosfatidilcolina, son moléculas precursoras de la acetilcolina, el principal neurotransmisor del sistema nervioso central y periférico (30). Actualmente se sugiere la suplementación con colina en aquellas enfermedades que se relacionan con deficiencia de este neurotransmisor, como es el caso de la enfermedad de Alzheimer y Huntington (31, 32).
La fosfatidilserina aporta el aminoácido serina y aunque no es un aminoácido esencial para el humano, tiene importantes funciones en la actividad catalítica de muchas enzimas. Finalmente, el fosfatidilinositol aporta inositol el que transformado en inositoltrifosfato (IP3) es un importante segundo mensajero en muchas funciones celulares (33, 34). Por todos estos motivos, actualmente se ha establecido una creciente valorización de los fosfolípidos y particularmente de los FM por su importante contenido de AGPICL omega-3 (35).
Figura 1: Estructura de los fosfolípidos y trigliceridos.
Obtención de fosfolípidos marinos. Las fuentes para la obtención de FM no son muy numerosas actualmente y por esta razón esta búsqueda constituye un desafío tecnológico importante y de alto potencial de desarrollo (24). Comercialmente es posible obtener FM a partir del krill (Euphasia superba), un pequeño crustáceo que abunda en los mares antárticos (23). El krill se colecta por succión desde la biomasa y se somete a prensado a alta presión y con temperatura. De esta forma, se obtiene “aceite de krill” y de los sólidos se obtiene “harina de krill” la que es altamente demandada para nutrición animal.
Otra alternativa mas reciente y muy novedosa se basa en la obtencion de FM a traves de las huevas de arenque (Herring caviar). Sin embargo, el alto costo de este carotenoide derivó en la preparación de análogos sintéticos que son los que mayoritariamente se utilizan en la nutrición de salmones. El precio internacional de los fosfolípidos es cercano a U$ 170-180/kg, precio que depende de la concentración de fosfolípidos. Actualmente solo algunas empresas europeas ofrecen este producto.
Otra alternativa, en fase industrial en algunos países, es la obtención de fosfolípidos a partir de microalgas marinas (38). Estos microorganismos cuando son cultivados en condiciones adecuadas (bioreactores que generan gran cantidad de biomasa) permiten obtener fosfolípidos con alta proporción de DHA y AA, actualmente utilizados en el enriquecimiento de fórmulas sustituto de leche materna para la alimentación de lactantes y también productos para los individuos mayores (16). Tambien de la harina de pescado, un producto de alta demanda para la alimentación animal, se obtiene a partir de peces pelágicos los que una vez capturados son sometidos a un proceso de cocción y prensado con lo cual se obtiene una fracción sólida, la que posteriormente es secada, es la harina. La fracción líquida está constituida por una mezcla de aceite y agua que por posterior separación genera el aceite de pescado, otro producto de alta demanda y precio internacional (13). La mayor proporción de los lípidos contenidos en los pescados queda en el aceite, principalmente en la forma de triglicéridos. Sin embargo, un remanente de estos (7-10%) queda en la harina, resultando un inconveniente para el productor de harina porque debido al alto grado de insaturación de los ácidos grasos, estos se oxidan con facilidad pudiendo producir incluso la inflamación de la harina, aspecto que constituye un peligro potencial, sobre todo en productos de exportación.
Este proceso se evita o reduce mediante la adición de antioxidantes a la harina, lo cual constituye un costo extra. Los lípidos residuales en la harina son principalmente fosfolípidos ricos en AGPICL omega-3 (35). Su extracción es compleja ya que estas moléculas, que principalmente forman parte de las membranas celulares, quedan atrapadas en el componente proteico de la matriz estructural de estas membranas, formada por fosfolípidos (39).
CONCLUSIONES.
los aceites marinos son importantes; mayor contenido de AGPICL omega-3, mayor facilidad de incorporación a diferentes matrices, mayor biodisponibilidad, mayor estabilidad, mejor comportamiento organoléptico, todas ellas hacen que estos productos sean de gran interés actual. Sin embargo, es necesario mayor investigación y desarrollo para identificar nuevas fuentes de FM. La alternativa actual, el aceite de krill, probablemente se verá limitada por regulaciones internacionales sobre su captura. Las microalgas pueden sustituir al aceite de krill como otra alternativa de carácter renovable aunque aún resulta costoso su cultivo. En un futuro próximo, la utilización de la harina de pescado o de las huevas de pescados seleccionados pueden resultar ser unas alternativas, de bajo costo la primera, no asi la segunda, para la obtención de FM, facilitando así su utilización en el desarrollo de nuevos productos, para la suplementación con AGPICL omega-3, tan necesaria en aquellos grupos que se caracterizan por un bajo consumo de estos nutrientes.
RESUMEN.
El déficit nutricional de ácidos grasos omega-3 de cadena larga (AGPICL omega-3), especialmente de ácido eicosapentaenoico y ácido docosahexaenoico en la población occidental debido al bajo consumo de productos del mar, es motivo actual de preocupación. La alternativa más clásica es el desarrollo de productos que contengan aceite de pescado conteniendo triglicéridos con alto contenido de AGPICL omega-3 en diferentes modalidades; aceite como tal, encapsulado, microencapsulado, o nanoencapsulado. Sin embargo, en cualquiera de estas modalidades, siempre se produce la reversión del olor y sabor, impidiendo así su consumo. Actualmente, los fosfolípidos de origen marino representan una alternativa mucho más interesante y de mayor impacto nutricional para suplementar AGPICL omega-3. Estos productos naturales presentan altas concentraciones de AGPICL omega-3, principalmente de ácido docosahexaenoico, son más estables a la oxidación, de mayor biodisponibilidad que los triglicéridos y además aportan otros nutrientes derivados de su estructura, también beneficiosos para la salud. Sin embargo, las alternativas para la obtención de fosfolípidos marinos a nivel industrial son actualmente pocas y posiblemente sujetas a control o restricción futura. Este trabajo analiza las principales ventajas de los fosfolípidos marinos en relación a los triglicéridos derivados del aceite de pescado como aporte de AGPICL omega-3, las principales fuentes de estos nutrientes, como lo son algunos aceites obtenidos de crustáceos, la harina de pescado o las futuras alternativas de desarrollo (huevas) para proveer a la industria farmacéutica, nutracéutica y de alimentos AGPICL omega-3 a partir de fosfolípidos marinos.
Agradecimientos: Los autores agradecen a la Fundación COPEC-UC (Proyecto 2013 R 92, R. Valenzuela) y a INNOVA- CORFO (Proyecto 12PIE-17901, A Valenzuela y F De la Barra) el apoyo otorgado a las respectivas investigaciones.
BIBLIOGRAFÍA.
1- Calder P. Omega-3 fatty acids and inflammatory processes: nutrition or pharmacology? Brit J Clin Pharmacol. 2012; 75: 645-62.
2 – Mozaffarian D, Wu J. Fatty acids and cardiovascular health: Are effects of EPA and DHA shared or complementary? J Nutr. 2012; 142: S614-25.
3 – Swanson D, Block R, Mousa S. Omega-3 fatty acids EPA and DHA: health benefits throughout life. Adv Nutr. 2012; 3; 1-7.
4 – Narayan B, Miyashita K, Hosokawa M. Physiological ef- fects of eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA): a review. Food Rev Int. 2006; 22; 291-307.
5 – Riediger N, Othman R, Suh M, Moghadasian M. A systemic review of the roles of n-3 fatty acids in health and disease. J Am Diet Assoc. 2009; 109: 668-79.
6 – Richardson A, Burton J, Thees S, et al. Docosahexaenoic acid for reading, cognition and behavior in children aged 7-9 years: A randomized controlled trial (The DOLAB study). Plos One 2012; 7: 1-14.
7 – Huang T. Omega-3 fatty acids, cognitive decline, and Al- zheimer’s disease: a critical review and evaluation of the literature. J Alzheimer’s Dis. 2010; 21: 673-90.
8 – Valenzuela R, Sanhueza J, Valenzuela A. Docosahexaenoic acid (DHA), an important fatty acid in aging and the pro- tection of neurodegenerative diseases. J Nut Ther. 2012; 1: 63-72.
9 – Valenzuela R, Tapia G, González M, et al. Ácidos grasos omega-3 y su aplicación en diversas situaciones clínicas. Rev Chil Nutr. 2011; 38: 356-67.
10 – FAO (Food and Agriculture Organization). Fats and fatty acids in human nutrition. 2010. Paper 91.
11 – WHO/FAO Expert Consultation on the risks and benefits of fish consumption. FAO Fisheries and Aquaculture Report, 978 rOMA, 2010.
12 – Larsen R, Eilertsen K, Elvevoll H. Health benefits of marine foods and ingredients. Biotechnol Adv. 2011; 29: 508-18.
13 – Valenzuela A, Sanhueza J, De la Barra F. El aceite de pes- cado: ayer un deshecho industrial, hoy un producto de alto valor nutricional. Rev Chil Nutr. 2012; 39: 201-9.
14 – Valenzuela A. Aceites marinos y su importancia en la salud y nutrición humana y animal. Aceites Grasas. 2009; XIX: 154-61.
15 – Decker E, Akoh C, Wilkes R. Incorporation of n-3 fatty acids in foods: challenges and opportunities. J Nutr. 2012; 142; S610-3.
16 – Taneja A, Singh H. Challenges for the delivery of long-chain n-3 fatty acids in functional goods. Annu Rev Food Sci Technol. 2012; 3: 105-23.
17 – McClements D. Edible nanoemulsions: fabrication, proper- ties, and functional performance. Soft Matter. 2010; 6: 2297-316.
18 – Kralovec J, Zhang S, Zhang A, Barrow C. A review of the progress in enzymatic concentration and microencapsula- tion of omega-3 rich oil from fish and microbial sources. Food Chem. 2012; 132; 639-44.
19 – Chen B, Mc Clements D, Decker E. Design foods with bioactive lipids for improve health. Annu Rev Food Sci Technol. 2013; 4: 35-56.
20 – Valenzuela A, Sanhueza J. Lípidos estructurados y los sustitutos de grasas: Los lípidos del futuro. Aceites Grasas, 2008; XVIII: 230-7.
21 – Parmentier M, Al Sayed M, Linder M, et al. Polar lipids: n-3 PUFA carriers for membrane and brain: nutritional interest and emerging processes. OCL. 2007; 14: 224-9.
22 – Arterburn L, Hall E, Oken H. Distribution, interconversion and dose response of n-3 fatty acids in humans. Am J Clin Nutr. 2006; 18: S1467-76.
23 – Burri L. The power of omega-3 phospholipids. Omega-3 fatty acids from Superb krill oil show increased bioavailabil- ity compared to triglyceride omega-3. Agro Food Industry Hi Technol. 2011; 22; 10-5.
24 – Burri L, Hoem N, Banni S, et al. Marine omega-3 phos- pholipids: metabolism and biological activities. Int J Mol Sci. 2012; 13: 15401-19.
25 – Valenzuela A, Sanhueza J. El tejido adiposo: algo más que un reservorio de energía. Grasas Aceites. 2009; 60: 439-52.
26 – Schuchardt J, Schneider I, Meyer H, Neubronner J, et al. Incorporation of EPA and DHA into plasma phospholipids in response to different omega-3 fatty acid formulation. A comparative bioavailability study of fish oil vs krill oil. Lipids Health Dis. 2011; 10: 145-52.
27 – Henna L, Nielsen N, Timm-Heinrich M, Jacobsen C. Oxida- tive stability of marine phospholipids in the liposomal form and their applications. Lipids. 2011; 46; 3-23.
28 – Murru E, Banni S, Carta G. Nutritional properties of dietary omega-3-enriched phospholipids. 2013. Biomed Res Int. 2013:965417. doi: 10.1155/2013/965417.
29 – Schuchardt J, Hahn A.Bioavailability of long-chain omega-3 fatty acids. 2013. Prostaglandins Leukot Es- sent Fatty Acids. 2013. 89:1-8. doi: 10.1016/j.plefa. 2013.03.010.
30 – Zeisel SH. 2012. A brief history of choline. Ann Nutr Metab. 61(3):254-258. doi: 10.1159/000343120. Epub 2012 Nov 26.
31 – Fu AL, Li Q, Dong ZH, Huang SJ, Wang YX, Sun MJ. 2004. Alternative therapy of Alzheimer’s disease via supplementa- tion with choline acetyltransferase. Neurosci Lett. 2004. 368(3):258-262.
32 – Hut RA, Van der Zee EA. The cholinergic system, circadian rhythmicity, and time memory. 2011. Behav Brain Res. 221:466-4 80. doi: 10.1016/j.bbr.2010.11.039.
33 – Xia HJ, Yang G. Inositol 1,4,5-trisphosphate 3-kinases: functions and regulations. Cell Res. 2005; 15:83-891.
34 – Decrock E, De Bock M, Wang N, Gadicherla AK, Bol M, Delvaeye T, Vandenabeele P, Vinken M, Bultynck G, Krysko DV, Leybaert L. IP3, a small molecule with a powerful message. 2013. Biochim Biophys Acta. 1833:1772-1786. doi: 10.1016/j.bbamcr.2012.12.016.
35 – Valenzuela A, Valenzuela R. Ácidos grasos omega3 con fines nutricionales ¿Cómo obtenerlos? Rev Chil Nutr. 2014 (en prensa).
36 – Hussein G, Sakawa U, Goto H, et al. Astaxanthin, a carot- enoid with potential in human health and nutrition. J Nat Prod. 2006; 69: 443-9.
37 – Choi H, Kim J, Chang M, et al. Effects of astaxantin on oxidative stress in overweight and obese adults. Phytother Res. 2011; 25: 1813-8.
38 – Adarme-Vega T, Dky L, Timmis M, et al. Microalgal biofactories: a promising approach towards sustainable omega-3 fatty acid production. Microbial Cell Fact. 2012; 11; 96-101.
39 – Dumay J, Allery M, et al. Optimization of hydrolysis of sardine (Sardina pilchardus) heads with Protamex: enhance- ment of lipids and phospholipids extraction. J Sci Food Agric. 2009; 89: 1599-606.




